Jakarta - Senyum penuh kebanggaan kembali ditorehkan generasi muda Indonesia pada negeri tercinta. Para pelajar SMA yang tergabung dalam Tim Olimpiade Astronomi dan Astrofisika Indonesia meraih peringkat 3 dunia pada The 7th International Olympiad on Astronomy and Astrophysics (IOAA) pada 27 Juli-5 Agustus lalu.
Dari 39 negara peserta, tim Indonesia berhasil meraih nilai total sebesar 194,6. Skor Indonesia mengungguli tim dari China yang duduk di peringkat 4 dengan nilai 182,1. Sementara India meraih peringkat 5 dengan nilai 181,4.
Namun, anggota tim masih belum bisa mengalahkan Korea Selatan yang menduduki peringkat pertama dengan skor 211,2 dan Singapura di peringkat ke-2 dengan skor 201,7. Mereka harus puas duduk di posisi 3 dunia.
Seperti dilansir dari Setkab.go.id,Minggu (11/8/2013), anggota Tim Olimpiade Astronomi dan Astrofisika Indonesia berasal dari berbagai sekolah di sejumlah daerah.
Mereka yakni M Imam Adli (SMA Kharisma Bangsa, Banten), David Orlando Kurniawan (SMAK 1 Penabur, Jakarta), Marcelina Viana (SMA Santa Ursula, Jakarta), Rizki Wahyu Pangestu (SMAN 1 Banjarnegara, Jawa Tengah), dan R Aryo Tri Adhimukti (SMAN 3 Malang, Jawa Timur).
Minggu, 11 Agustus 2013
Awesome ! Pelajar Indonesia meraih juara 3 Olimpiade Astronomi Internasional (IOAA)
Kamis, 08 Agustus 2013
Hari raya Idul Fitri | Mohon Maaf Lahir dan Batin
Di hari kemenangan bagi umat muslim se dunia ini, aku Husnul Nawafil. Mau meminta maaf kepada seluruh teman-teman yang selama ini udah mendukung Husnul dalam segala hal. Mohon maaf lahir dan batin ya teman-teman. Maklumin aja kalo banyak kesalahan karena segala kesalahan berasal dari diri Husnul dan segala kebaikan berasal dari Allah swt.
Minggu, 19 Mei 2013
Kumpulan Soal OSN Kimia
Berikut ini adalah kumpulan Soal OSN Kimia dari tahun 2004 sampai 2013, tapi mohon maaf itu belum semuanya lengkap, nanti jika saya sudah mendapatkan yang baru, insya Allah akan saya post kan.
OSN Kimia Tahun 2004
OSN Kimia Tahun 2004
- Soal OSN Kimia Tk Kab-Kota Tahun 2004
- Soal (teori pilihan ganda, teori essay, praktik) dan pembahasan OSN Kimia Tingkat Nasional Tahun 2004.
OSN Kimia Tahun 2005
- Soal OSN Kimia Tk Kab-Kota Tahun 2005
- Soal OSN Kimia Tk Provinsi Tahun 2005
- Soal (teori pilihan ganda, teori essay, praktik) dan Pembahasan OSN Kimia Tingkat Nasional Tahun 2005
OSN Kimia Tahun 2006
- Soal OSN Kimia Tk Kab-Kota Tahun 2006
- Soal OSN Kimia Tk Provinsi Tahun 2006
- Soal (teori dan praktik) serta Pembasahan OSN Kimia Tingkat Nasional 2006
OSN Kimia Tahun 2007
OSN Kimia Tahun 2008
- Soal dan pembahasan OSN Kimia Tingkat Kabupaten/Kota Tahun 2008
- Soal dan pembahasan OSN Kimia Tingkat Provinsi Tahun 2008
- Soal (teori dan praktik) dan jawaban OSN Kimia Tingkat Nasional 2008.
- Soal dan Pembahasan OSN Kimia Tingkat Kabupaten Tahun 2009
- Soal OSN Kimia Tk Provinsi Tahun 2009
- Soal OSN Kimia Tk Nasional Tahun 2009
- Soal dan Jawaban OSN Kimia Tk Kabupaten-Kota Tahun 2010
- Soal dan Jawaban OSN Kimia Tk Povinsi Tahun 2010
- Soal dan Jawaban OSN Kimia Tk Nasional Tahun 2010
- Soal OSN Kimia Tk Kab-kota Tahun 2011
- Soal OSN Kimia Tk Provinsi Tahun 2011
- Soal dan Jawaban OSN Kimia Tk Nasional Tahun 2011
- Soal dan Jawaban OSN Kimia Tk Kabupaten-Kota Tahun 2012 paket A
- Soal dan Jawaban OSN Kimia Tk Kabupaten-Kota Tahun 2012 paket B
- Soal dan Jawaban OSN Kimia Tk Kabupaten-Kota Tahun 2012 paket C
- Soal dan Jawaban OSN Kimia Tk Provinsi Tahun 2012
- Soal dan Jawaban OSN Kimia Tk Nasional Tahun 2012
Bahasa Melayu Pasai (Aceh), Asal Mula Lahirnya Bahasa Nasional Indonesia
Bahasa Melayu Pasai (Aceh), Asal Mula Lahirnya Bahasa Nasional Indonesia
Oleh T.A. Sakti Pemerhati Sejarah dan Budaya Aceh
Foto : Peta Kerajaan Aceh Di Masa Sultan Iskandar Muda 1608-1637 M
- Fakta sejarah yang ingin penulis selipkan adalah sumbangan jasa, bahkan pelimpahan, pemberian secara menyeluruh dari para ulama-pujangga-sastrawan Aceh-sejak Kerajaan Samudera Pasai Sampai Kerajaan Aceh Darussalam- dalam pembinaan dan pengembangan bahasa Melayu Jawi atau Melayu Pasai, sehingga bahasa Indonesia dapat berkembang seperti sekarang. Dengan sumbangan-sumbangan pelimpahan jasa para ulama-sastrawan Aceh, serta setelah bangkitnya pergerakan rakyat Indonesia, pada tanggal 28 Oktober 1928 dengan insaf diangkat sebagai bahasa persatuan Indonesia. Memang, jasa Aceh amat sahih!
Bahasa Melayu merupakan akar utama dari bahasa Indonesia. Sepanjang sejarah perkembangannya, bahasa Melayu terus-menerus diperkaya sehingga ia semakin mantap berperan di seluruh wilayah Nusantara. Bahasa Melayu masih dapat dilacak jejaknya mulai abad ke-7, masa Kerajaan Sriwijaya, yaitu berupa prasasti-prasasti yang menggunakan bahasa Melayu Kuno, seperti prasasti Kedukan Bukit (Tahun 683 M), Talang Tuo (Tahun 684), dan lain-lain. Seiring dengan timbul-tenggelamnya kerajaan-kerajaan di Asia Tenggara dan datangnya penjajahan asing, bahasa Melayu pun mendapat predikat yang berbeda-beda dalam perkembangannya; seperti bahasa Melayu Pasai, bahasa Melayu Melaka, bahasa Melayu Johor, bahasa Melayu Riau, bahasa Melayu Balai Pustaka, dan bahasa Nasional Indonesia.
Berkaitan dengan hal ini, dalam bukunya yang berjudul Kesusasteraan Melayu Klasik Sepanjang Abad, Dr. Teuku Iskandar menjelaskan sebagai berikut: “Jika sebuah pusat kerajaan menjadi penting dari sudut politik dan ekonomi, kaum cerdik pandai dan pujangga-pujangga, baik dari dalam negeri maupun dari luar negeri, akan bertumpu ke tempat itu. Dengan jalan demikian lahirlah sebuah pusat kebudayaan dan pusat kesusasteraan. Munculnya pusat politik dan pusat ekonomi baru akan melemahkan pusat kekuasaan lama dan pusat kebudayaan berpindah dari sini ke pusat yang baru. Tiap pusat kebudayaan yang baru itu akan memberi nafas baru pada kesusasteraan Melayu yang telah ada dan dengan jalan demikian mencetuskan genre atau genre-genre baru dalam kesusasteraan Melayu. Sesuatu genre kesusasteraan yang lahir di sebuah pusat kebudayaan akan tersebar ke sekitarnya dan dilanjutkan di sana. Kadang-kadang pula genre baru ini dilanjutkan terus di tempat-tempat yang terpencil, walaupun di pusat kebudayaan lain telah lahir genre kesusasteraan yang lebih baru lagi.”
Bahasa Melayu Pasai berkembang pada masa Kerajaan Samudera Pasai (1250-1524 M). Kerajaan ini amat berperan dalam penyebaran agama Islam ke berbagai wilayah di Asia Tenggara, seperti ke Melaka dan Jawa. Bersamaan berkembangnya agama Islam itu tersebar pula bahasa Melayu Pasai di wilayah tersebut melalui kitab-kitab pelajaran agama Islam yang menggunakan bahasa Melayu Pasai sebagai pengantarnya.
Kerajaan Samudera Pasai berhubungan akrab dengan Kerajaan Melaka. Perkawinan antara Sultan Melaka Iskandar Syah dengan putri Sultan Zainal Abidin dari Samudera Pasai semakin mempererat hubungan kedua negara itu. Sultan Samudera juga telah mengutus dua orang ulama ke pulau Jawa untuk mengembangkan agama Islam. Berkat dakwah Islam yang dilakukan oleh Maulana Malik Ibrahim dan Maulana Ishak, agama Islam berkembang di Gresik, dan seterusnya menyebar ke seluruh pulau Jawa.
Bahasa Melayu Pasai Menuju Bahasa Nasional Indonesia
Perkembangan bahasa Melayu Jawi sejak Kerajaan Samudera Pasai sampai saat berdirinya Republik Indonesia tentu telah melewati waktu yang berabad-abad lamanya. Prof. Dr. Teuku Iskandar mengatakan bahwa “Kesusasteraan Melayu yang dimulai di Kerajaan Pasai dan dilanjutkan di Kerajaan Aceh berkembang selama lebih dari 650 tahun.”
Berdasarkan semua uraian yang telah dikemukakan kiranya definisi bahasa Indonesia yang diketengahkan oleh sejarawan, ilmuan, dan budayawan Prof. Dr. Teuku Ibrahim Alfian, M.A dari Universitas Gadjah Mada diberikan sedikit catatan tambahan untuk meluruskan fakta sejarah Indonesia.
Dalam makalah yang berjudul “Proses Perkembangan Bahasa Jawi di Samudera Pasai (Aceh Utara) Menjadi Bahasa Nasional Indonesia”, setelah melakukan redefinisi bahasa Indonesia Sutan Takdir Alisyahbana, Teuku Ibrahim Alfian memberi definisi bahasa Indonesia yaitu bahasa perhubungan yang berabad-abad tumbuh perlahan-lahan di antara penduduk Asia Tenggara, yang terjelma menjadi bahasa Jawi/Melayu dan telah diangkat oleh agama Islam sebagai bahasa ilmu dan kebudayaan.

Oleh T.A. Sakti Pemerhati Sejarah dan Budaya Aceh
Foto : Peta Kerajaan Aceh Di Masa Sultan Iskandar Muda 1608-1637 M
- Fakta sejarah yang ingin penulis selipkan adalah sumbangan jasa, bahkan pelimpahan, pemberian secara menyeluruh dari para ulama-pujangga-sastrawan Aceh-sejak Kerajaan Samudera Pasai Sampai Kerajaan Aceh Darussalam- dalam pembinaan dan pengembangan bahasa Melayu Jawi atau Melayu Pasai, sehingga bahasa Indonesia dapat berkembang seperti sekarang. Dengan sumbangan-sumbangan pelimpahan jasa para ulama-sastrawan Aceh, serta setelah bangkitnya pergerakan rakyat Indonesia, pada tanggal 28 Oktober 1928 dengan insaf diangkat sebagai bahasa persatuan Indonesia. Memang, jasa Aceh amat sahih!
Bahasa Melayu merupakan akar utama dari bahasa Indonesia. Sepanjang sejarah perkembangannya, bahasa Melayu terus-menerus diperkaya sehingga ia semakin mantap berperan di seluruh wilayah Nusantara. Bahasa Melayu masih dapat dilacak jejaknya mulai abad ke-7, masa Kerajaan Sriwijaya, yaitu berupa prasasti-prasasti yang menggunakan bahasa Melayu Kuno, seperti prasasti Kedukan Bukit (Tahun 683 M), Talang Tuo (Tahun 684), dan lain-lain. Seiring dengan timbul-tenggelamnya kerajaan-kerajaan di Asia Tenggara dan datangnya penjajahan asing, bahasa Melayu pun mendapat predikat yang berbeda-beda dalam perkembangannya; seperti bahasa Melayu Pasai, bahasa Melayu Melaka, bahasa Melayu Johor, bahasa Melayu Riau, bahasa Melayu Balai Pustaka, dan bahasa Nasional Indonesia.
Berkaitan dengan hal ini, dalam bukunya yang berjudul Kesusasteraan Melayu Klasik Sepanjang Abad, Dr. Teuku Iskandar menjelaskan sebagai berikut: “Jika sebuah pusat kerajaan menjadi penting dari sudut politik dan ekonomi, kaum cerdik pandai dan pujangga-pujangga, baik dari dalam negeri maupun dari luar negeri, akan bertumpu ke tempat itu. Dengan jalan demikian lahirlah sebuah pusat kebudayaan dan pusat kesusasteraan. Munculnya pusat politik dan pusat ekonomi baru akan melemahkan pusat kekuasaan lama dan pusat kebudayaan berpindah dari sini ke pusat yang baru. Tiap pusat kebudayaan yang baru itu akan memberi nafas baru pada kesusasteraan Melayu yang telah ada dan dengan jalan demikian mencetuskan genre atau genre-genre baru dalam kesusasteraan Melayu. Sesuatu genre kesusasteraan yang lahir di sebuah pusat kebudayaan akan tersebar ke sekitarnya dan dilanjutkan di sana. Kadang-kadang pula genre baru ini dilanjutkan terus di tempat-tempat yang terpencil, walaupun di pusat kebudayaan lain telah lahir genre kesusasteraan yang lebih baru lagi.”
Bahasa Melayu Pasai berkembang pada masa Kerajaan Samudera Pasai (1250-1524 M). Kerajaan ini amat berperan dalam penyebaran agama Islam ke berbagai wilayah di Asia Tenggara, seperti ke Melaka dan Jawa. Bersamaan berkembangnya agama Islam itu tersebar pula bahasa Melayu Pasai di wilayah tersebut melalui kitab-kitab pelajaran agama Islam yang menggunakan bahasa Melayu Pasai sebagai pengantarnya.
Kerajaan Samudera Pasai berhubungan akrab dengan Kerajaan Melaka. Perkawinan antara Sultan Melaka Iskandar Syah dengan putri Sultan Zainal Abidin dari Samudera Pasai semakin mempererat hubungan kedua negara itu. Sultan Samudera juga telah mengutus dua orang ulama ke pulau Jawa untuk mengembangkan agama Islam. Berkat dakwah Islam yang dilakukan oleh Maulana Malik Ibrahim dan Maulana Ishak, agama Islam berkembang di Gresik, dan seterusnya menyebar ke seluruh pulau Jawa.
Bahasa Melayu Pasai Menuju Bahasa Nasional Indonesia
Perkembangan bahasa Melayu Jawi sejak Kerajaan Samudera Pasai sampai saat berdirinya Republik Indonesia tentu telah melewati waktu yang berabad-abad lamanya. Prof. Dr. Teuku Iskandar mengatakan bahwa “Kesusasteraan Melayu yang dimulai di Kerajaan Pasai dan dilanjutkan di Kerajaan Aceh berkembang selama lebih dari 650 tahun.”
Berdasarkan semua uraian yang telah dikemukakan kiranya definisi bahasa Indonesia yang diketengahkan oleh sejarawan, ilmuan, dan budayawan Prof. Dr. Teuku Ibrahim Alfian, M.A dari Universitas Gadjah Mada diberikan sedikit catatan tambahan untuk meluruskan fakta sejarah Indonesia.
Dalam makalah yang berjudul “Proses Perkembangan Bahasa Jawi di Samudera Pasai (Aceh Utara) Menjadi Bahasa Nasional Indonesia”, setelah melakukan redefinisi bahasa Indonesia Sutan Takdir Alisyahbana, Teuku Ibrahim Alfian memberi definisi bahasa Indonesia yaitu bahasa perhubungan yang berabad-abad tumbuh perlahan-lahan di antara penduduk Asia Tenggara, yang terjelma menjadi bahasa Jawi/Melayu dan telah diangkat oleh agama Islam sebagai bahasa ilmu dan kebudayaan.

Minggu, 12 Mei 2013
Puisi : Siapa kau...?
Siapa kau...?
Karya : Ahmad Syafiq Zuhri
Awal
Dalam kemewahan nan elegan
Dalam kota yang panas dan terik
Aku menemukan dia
Awal bertemu dengan dia
Konsentrasiku hilang
Pikiranku buyar
Detak jantung tak beraturan
Siapa kau....?
Yang telah menghilangkan minatku terhadap nilai riil
Kau telah membawaku jauh ke awang-awang
Menembus pikiran tiada batas
Ketahuilah kawan
Aku paling benci saat ilmu di otakku berlari kesana kemari
Dan kini itu terjadi
Karena dia...!!
Siapa kau.....?
Tidurku tak nyenyak karena terbayang wajahmu
Kau memang pengganggu....!!
Aku sangat benci dengan keadaan ini
Namun, perlu kau ketahui kawan
Dibalik kegelapan benci
Ada sinar terang bahagia
Ya, kawan...
Walau aku benci
Namun aku sangat bahagia
Bisa bertemu dengan dia
Puisi : Mutiara
Berikut ini adalah puisi untuk orang yang kusayangi, tapi kami berada dalam jarak yang jauh.
Mutiara
Karya : Husnul Nawafil
Tahukah kau kawan ?Apa itu mutiara?
Bagiku, itu adalah sesuatu
Sesuatu yang indah, berkilau, cantik, dan penuh ketenangan
Hari itu
Kutelah menemukan mutiara paling indah di dunia
Takkan bisa tergambar oleh lukisan
Takkan terlukiskan kata-kata
Dalam kemewahan masa kini
Ku menemukan mutiara itu
Aku tak menemukan topaz, permata, intan, atau zamrud
Yang ada hanya mutiara
Mutiara yang sangat bening
Lebih bening dari air yang bisu
Kilaunya menyejukkan hati
Aku seakan terbawa cinta
Awal bertemu
Rasanya ingin kupeluk dunia ini
Senyum manis selalu terkembang
Mutiara itu telah mengobati hatiku
Namun.....
Jarak bersikap kejam
Waktu menyiksaku
Mereka memisahkan aku dengan mutiara itu
Senyumku kembali masam
Hati seperti tersayat pedang tajam
Otakku seakan kram
Aku tenggelam dalam bayangan kelam
Mutiara itu telah pergi
Menuju negeri yang penuh keramaian
Yang penuh persaingan satu sama lain
Untuk mendapatkan ilmu yang tinggi
Kini, yang ada hanya aku
Aku dalam bayangan hitam
Yang terus mencari sinar mutiara itu
Akankah kami dapat bertemu kembali?
Mutiara
Karya : Husnul Nawafil
Tahukah kau kawan ?Apa itu mutiara?
Bagiku, itu adalah sesuatu
Sesuatu yang indah, berkilau, cantik, dan penuh ketenangan
Hari itu
Kutelah menemukan mutiara paling indah di dunia
Takkan bisa tergambar oleh lukisan
Takkan terlukiskan kata-kata
Dalam kemewahan masa kini
Ku menemukan mutiara itu
Aku tak menemukan topaz, permata, intan, atau zamrud
Yang ada hanya mutiara
Mutiara yang sangat bening
Lebih bening dari air yang bisu
Kilaunya menyejukkan hati
Aku seakan terbawa cinta
Awal bertemu
Rasanya ingin kupeluk dunia ini
Senyum manis selalu terkembang
Mutiara itu telah mengobati hatiku
Namun.....
Jarak bersikap kejam
Waktu menyiksaku
Mereka memisahkan aku dengan mutiara itu
Senyumku kembali masam
Hati seperti tersayat pedang tajam
Otakku seakan kram
Aku tenggelam dalam bayangan kelam
Mutiara itu telah pergi
Menuju negeri yang penuh keramaian
Yang penuh persaingan satu sama lain
Untuk mendapatkan ilmu yang tinggi
Kini, yang ada hanya aku
Aku dalam bayangan hitam
Yang terus mencari sinar mutiara itu
Akankah kami dapat bertemu kembali?
Puisi : Cukup
Berikut adalah puisi singkat yang kami (aku dan ahmad syafiq zuhri) buat pada saat kami lagi bersama-sama di asrama..
CUKUP
Karya : Ahmad Syafiq Zuhri
Cukup
Sudah cukup
Aku tak butuh lagi pesonamu
Aku tak butuh lagi senyummu
Senyummu dahulu semanis madu
Sekarang kurasakan pahitnya empedu
Pesonamu dahulu membuat hati bergetar
Kini aku terkapar
Saat itu batinku terkesan
Kau layaknya bunga krisan
Yang mengembang dikala hati hujan
Membuat aku merasa nyaman
Namun,apalah daya
Hati kini sudah merana
Kau sudah merajam
Dengan berjuta-juta pedang yang tajam
Kau adalah palsu
Kau hanyalah semu
Kau membuat kelu
Kau membawa pilu
Cukup….
Sudah cukup
Aku tak butuh
Aku tak butuh kamu lagi..!
7 Pulau Paling Menakutkan Di Dunia
1. Ilha de Queimada Grande (Pulau Ular), Brazil
 |
| Pulau Paling Menakutkan di Dunia |
Seorang nelayan ditemukan tewas bersimbah darah di kapalnya karena
serangan ular, dan sebuah keluarga dibunuh oleh serangan ular di malam
hari. Tunggu, ini bukanlah deskripsi cerita film INDIANA JONES atau
ANACONDA, namun ini yang terjadi di pulau Ilha de Queimada Grande ini.
Terdengar kurang mengerikan? Disebutkan populasi ular di pulau ini digambarkan bahwa setiap satu meter persegi diisi oleh hampir lima ekor ular. Ini adalah pulau yang menjadi surga ular di dunia.
Terdengar kurang mengerikan? Disebutkan populasi ular di pulau ini digambarkan bahwa setiap satu meter persegi diisi oleh hampir lima ekor ular. Ini adalah pulau yang menjadi surga ular di dunia.
2. Pulau Poveglia, Italia

Terletak
di sebuah teluk di Venice, Italia, pulau ini seakan menggambarkan apa
yang ada dalam film HOSTEL, SHUTTER ISLAND dan SUCKER PUNCH. Awalnya
Poveglia adalah semacam lokasi ‘pembuangan’ bagi mereka yang terjangkit
wabah penyakit. Ribuan orang dikarantina di lokasi ini dan mereka pun
meninggal di pulau Poveglia.
Sekitar 160 ribu orang meninggal di Poveglia, dengan tulang-tulang mereka yang dikremasi. Seakan belum mengerikan, pada tahun 1922 dibangun rumah sakit mental dengan bunyi lonceng yang menyeramkan. Rumor menyebutkan dokter rumah sakit seringkali melakukan lobotomi untuk para pasien jiwa.
Sekitar 160 ribu orang meninggal di Poveglia, dengan tulang-tulang mereka yang dikremasi. Seakan belum mengerikan, pada tahun 1922 dibangun rumah sakit mental dengan bunyi lonceng yang menyeramkan. Rumor menyebutkan dokter rumah sakit seringkali melakukan lobotomi untuk para pasien jiwa.
3. Pulau Ramree, Myanmar

Pada
tahun 1945, sekitar 900 orang tentara Jepang menyerang pulau kecil di
pantai Myanmar. Melintasi rawa-rawa, musuh para tentara yang sebenarnya
justru ada di lokasi itu. Hasilnya? 500 orang tentara tewas diserang
oleh sekelompok buaya air tawar.
Pulau Ramree diyakini bukan hanya rumah bagi nyamuk pembawa malaria atau kalajengking mematikan, namun juga predator paling mengerikan, buaya.
Pulau Ramree diyakini bukan hanya rumah bagi nyamuk pembawa malaria atau kalajengking mematikan, namun juga predator paling mengerikan, buaya.
4. Pulau Izu, Jepang

Untuk
bernafas kita butuh udara sehat yang mengandung oksigen, meskipun
akhir-akhir ini udara perkotaan sudah mengandung polusi. Namun
setidaknya udara itu tak mengandung unsur mematikan sulfur. Tapi yang
ada di pulau Izu ini adalah sulfur di udara.
Kandungan sulfur di pulau Izu diakibatkan oleh tingginya aktivitas vulkanis di sana. Izu menjadi lokasi dengan tingkat sulfur tertinggi di dunia, anehnya masih ada minoritas manusia yang tinggal di sana. Ingin ikut?
Kandungan sulfur di pulau Izu diakibatkan oleh tingginya aktivitas vulkanis di sana. Izu menjadi lokasi dengan tingkat sulfur tertinggi di dunia, anehnya masih ada minoritas manusia yang tinggal di sana. Ingin ikut?
5. Great Pacific Garbage Patch, Pasifik Utara

Jika
pulau-pulau biasa terbentuk dari daratan, maka pulau yang terletak di
Pasifik Utara ini dibuat dari tumpukan sampah. Dengan luas setara
dengan Texas, pulau ini berisi sampah-sampah yang diakibatkan pola
rotasi arus laut. Mungkin ketika terdampar di pulau ini kita akan jatuh
ke air dan disambut oleh ikan hiu.
6. Pulau Fiji, Melanisea

Apa
yang terlintas di pikiran saat melihat gambar pulau Fiji? Pulau indah
untuk bulan madu? Salah, buang jauh-jauh pikiranmu. Fiji justru dikenal
sebagai pulau dengan banyak insiden kematian misterius. Termasuk
cerita anak-anak kanibal, pembunuhan anak-anak, penyiksaan anak-anak.
Seseorang yang mendatangi pulau ini di tahun 1839 mengaku melihat mayat remaja laki-laki, perempuan, dan anak-anak dibawa ke Rewa sebagai tumbal untuk Tanoa. Bahkan mayat itu dimasak dan dimakan oleh populasi suku kanibal di sana, sudah jangan dilanjutkan, karena itu mengerikan.
Seseorang yang mendatangi pulau ini di tahun 1839 mengaku melihat mayat remaja laki-laki, perempuan, dan anak-anak dibawa ke Rewa sebagai tumbal untuk Tanoa. Bahkan mayat itu dimasak dan dimakan oleh populasi suku kanibal di sana, sudah jangan dilanjutkan, karena itu mengerikan.
7. Balls Pyramid, Australia
Balls Pyramid memiliki tinggi sekitar 1.800 kaki. Dihuni oleh serangga mengerikan yang disebut Drycocelus australis. Serangga yang juga sering disebut dengan Lord Howe ini berukuran 6 inchi dan tak bisa terbang. Meskipun tidak mematikan, namun bisa membuat menggigil.
Pantai-pantai dengan pasir unik di dunia
1. Pantai pasir hijau di Papakolea, Hawaii

Pantai Papakolea yang kaya akan mineral olivin (salah satu unsur utama yang dihasilkan oleh endapan lava gunung berapi di Hawaii) memiliki sebuah lekukan yang nyaris seperti kerucut silinder dengan pasir berwarna hijau tua yang surealis, terhampar bagai sebuah padang rumput. Pantai ini dapat Anda temukan di sebelah selatan Big Island, terlindungi oleh sebuah bukit yang lumayan tinggi.


Pantai Pink Lombok sebenarnya bukan temuan baru untuk Destinasi dan Objek Wisata Lombok. Pantai yang sebenarnya bernama Pantai Tangsi ini disebut sebagai Pantai Pink karena warna pasirnya yang di dominasi oleh warna Pink. Pantai yang berlokasi di desa kecil Sekaroh, Kecamatan Jerowaru Kabupaten Lombok Timur ini merupakan bagian dari Pantai Tanjung Ringgit, namun karena lokasi dan infrastruktur Jalan yang mungkin kurang memadai sehingga Pantai Pink ini menjadi tidak terekspose media dan wisatawan.
4. Pantai berpasir kaca di Fort Bragg, California


Pantai Papakolea yang kaya akan mineral olivin (salah satu unsur utama yang dihasilkan oleh endapan lava gunung berapi di Hawaii) memiliki sebuah lekukan yang nyaris seperti kerucut silinder dengan pasir berwarna hijau tua yang surealis, terhampar bagai sebuah padang rumput. Pantai ini dapat Anda temukan di sebelah selatan Big Island, terlindungi oleh sebuah bukit yang lumayan tinggi.
2. Pfeiffer Beach di kawasan Big Sur, California, yang berpasir ungu muda.

Di
malam hari, ketika sinar bulan memantul perlahan-lahan, maka partikel
mangan yang mewarnai pasir hingga terlihat ungu akan tampak bercahaya,
dan pantulannya di permukaan air tampak seperti aurora. Terbentang dari
sebelah selatan pantai hingga membentang ke utara, warna pasir secara
bertahap akan tampak makin pekat. Di siang hari, warnanya juga masih
tampak mempesona.
3. Pantai Pink Lombok, Indonesia

Pantai Pink Lombok sebenarnya bukan temuan baru untuk Destinasi dan Objek Wisata Lombok. Pantai yang sebenarnya bernama Pantai Tangsi ini disebut sebagai Pantai Pink karena warna pasirnya yang di dominasi oleh warna Pink. Pantai yang berlokasi di desa kecil Sekaroh, Kecamatan Jerowaru Kabupaten Lombok Timur ini merupakan bagian dari Pantai Tanjung Ringgit, namun karena lokasi dan infrastruktur Jalan yang mungkin kurang memadai sehingga Pantai Pink ini menjadi tidak terekspose media dan wisatawan.
4. Pantai berpasir kaca di Fort Bragg, California

Lokasi
yang suatu ketika pernah menjadi tempat pembuangan sampah ini kini
telah menjelma menjadi salah satu pantai buatan manusia yang paling
menakjubkan di dunia. Proses pasang surut pantai yang telah berjalan
selama beberapa dekade telah menghaluskan pecahan-pecahan kaca hingga
menjadi butiran kristal bergerigi yang nyaman di kaki. Hamparan kerikil
kaca yang bersekongkol dengan butiran pasir Fort Bragg adalah salah satu
destinasi wisata yang harus Anda kunjungi diantara semua gelimang
menyilaukan Kota California.
Minggu, 14 April 2013
E-book : Lebih Dari Sekedar "The Secret" Try before you die...
Ebook menarik ini saya dapatkan dari salah satu forum. Silahkan coba dibaca, isinya sangat menarik. Tenang aja, ukurannya cuma 600 Kb. Ingat! Cuma 600 Kb bukan 600 Mb,.. Insyaallah download-nya cepat kok
Semoga e-book ini dapat memotivasi kalian semua yang membaca...
Selamat mencoba!

Klik disini OK!
Asam, basa, dan garam
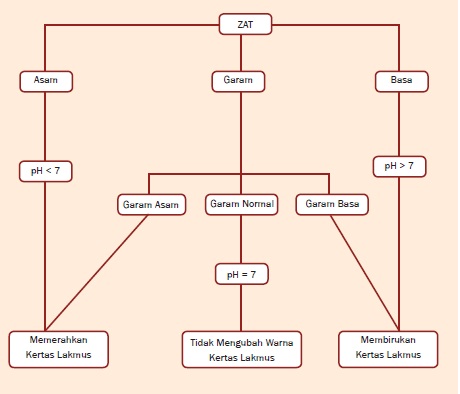
Peta Konsep
A. Sifat-Sifat Asam, Basa, dan Garam
Istilah asam (acid) berasal dari bahasa
Latin acetum yang berarti cuka. Seperti diketahui, zat utama dalam cuka
adalah asam asetat. Basa (alkali) berasal dari bahasa Arab yang berarti
abu.
Seperti halnya dengan sabun, basa
bersifat kaustik (licin), selain itu basa juga bersifat alkali (bereaksi
dengan protein di dalam kulit sehingga sel-sel kulit akan mengalami
pergantian). Rasa pahit merupakan salah satu sifat zat yang bersifat
basa.
Kita dapat mengenali asam dan basa dari
rasanya. Namun, kita dilarang mengenali asam dan basa dengan cara
mencicipi karena cara tersebut bukan merupakan cara yang aman. Untuk
mengidentifikasi asam dan basa yang baik dan aman dapat dengan
menggunakan indikator. Indikator yaitu suatu bahan yang dapat bereaksi
dengan asam, basa, atau garam sehingga akan menimbulkan perubahan warna.
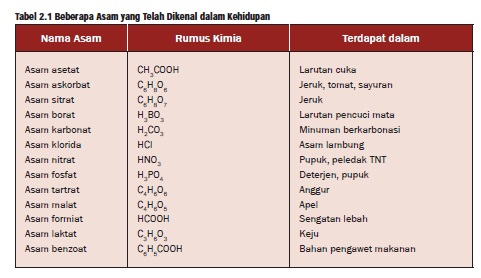
1. Asam
Asam merupakan salah satu penyusun dari
berbagai bahan makanan dan minuman, misalnya cuka, keju, dan
buah-buahan. Menurut Arrhenius, asam adalah zat yang dalam air akan
melepaskan ion H+. Jadi, pembawa sifat asam adalah ion H+ (ion
hidrogen), sehingga rumus kimia asam selalu mengandung atom hidrogen.
Ion adalah atom atau sekelompok atom yang bermuatan listrik. Kation
adalah ion yang bermuatan listrik positif. Adapun anion adalah ion yang
bermuatan listrik negatif.
Sifat khas lain dari asam adalah dapat
bereaksi dengan berbagai bahan seperti logam, marmer, dan keramik.
Reaksi antara asam dengan logam bersifat korosif. Contohnya, logam besi
dapat bereaksi cepat dengan asam klorida (HCl) membentuk Besi
(II) klorida (FeCl2).
Tabel beberapa contoh asam
Berdasarkan asalnya, asam dikelompokkan dalam 2 golongan, yaitu asam organik dan asam anorganik. Asam organik umumnya bersifat asam lemah, korosif, dan banyak terdapat di alam. Asam anorganik
umumnya bersifat asam kuat dan korosif. Karena sifat-sifatnya itulah,
maka asam-asam anorganik banyak digunakan di berbagai kebutuhan manusia.
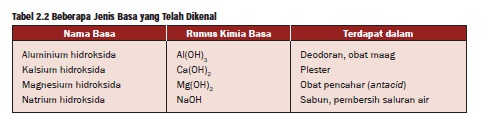
2.Basa
Dalam keadaan murni, basa umumnya berupa
kristal padat dan bersifat kaustik. Beberapa produk rumah tangga seperti
deodoran, obat maag (antacid) dan sabun serta deterjen mengandung basa.
Basa adalah suatu senyawa yang jika
dilarutkan dalam air (larutan) dapat melepaskan ion hidroksida (OH-).
Oleh karena itu, semua rumus kimia basa umumnya mengandung gugus OH.
Jika diketahui rumus kimia suatu basa,
maka untuk memberi nama basa, cukup dengan menyebut nama logam dan
diikuti kata hidroksida.
Tabel beberapa contoh Basa
Perbedaan Sifat Asam dan Basa
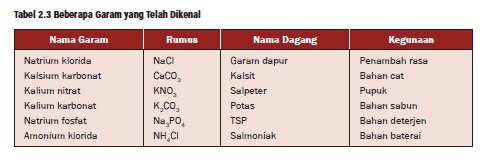
3. Garam
Orang mengalami sakit perut disebabkan
asam lambung yang meningkat. Untuk menetralkan asam lambung (HCl)
digunakan antacid. Antacid mengandung basa yang dapat menetralkan
kelebihan asam lambung (HCl).
Umumnya zat-zat dengan sifat yang
berlawanan, seperti asam dan basa cenderung bereaksi membentuk zat baru.
Bila larutan asam direaksikan dengan larutan basa, maka ion H+ dari
asam akan bereaksi dengan ion OH- dari basa membentuk molekul air.
H+ (aq) + OH- (aq) —> H2O (ℓ)
Asam Basa Air
Karena air bersifat netral, maka reaksi asam dengan basa disebut reaksi penetralan.
Ion-ion ini akan bergabung membentuk
senyawa ion yang disebut garam. Bila garam yang terbentuk ini mudah
larut dalam air, maka ion-ionnya akan tetap ada di dalam larutan. Tetapi
jika garam itu sukar larut dalam air, maka ion-ionnya akan bergabung
membentuk suatu endapan. Jadi, reaksi asam dengan basa disebut juga
reaksi penggaraman karena membentuk senyawa garam.
Mari kita simak contoh reaksi pembentukan garam berikut!
Mari kita simak contoh reaksi pembentukan garam berikut!
Asam + Basa —> Garam + Air
Asam klorida + Natrium hidroksida —> Natrium klorida + air
HCl (aq) + Na OH (aq) —> Na Cl (aq) + H2O (ℓ)
Asam Basa Garam Air
Walaupun reaksi asam dengan basa disebut
reaksi penetralan, tetapi hasil reaksi (garam) tidak selalu bersifat
netral. Sifat asam basa dari larutan garam bergantung pada kekuatan asam
dan basa penyusunnya.
Garam yang berasal dari asam kuat dan
basa kuat bersifat netral, disebut garam normal, contohnya NaCl dan
KNO3. Garam yang berasal dari asam kuat dan basa lemah bersifat asam dan
disebut garam asam, contohnya adalah NH4 Cl. Garam yang berasal dari
asam lemah dan basa kuat bersifat basa dan disebut garam basa, contohnya
adalah CH3COONa.
Contoh asam kuat adalah HCl, HNO3, H2SO4. Adapun KOH, NaOH,
Ca(OH)2 termasuk basa kuat.
Contoh asam kuat adalah HCl, HNO3, H2SO4. Adapun KOH, NaOH,
Ca(OH)2 termasuk basa kuat.
Tabel beberapa contoh garam
4. Larutan Asam, Basa, dan Garam Bersifat Elektrolit
Ketika seseorang mencari ikan dengan
menggunakan ”setrum” atau aliran listrik yang berasal dari aki, apa
yang terjadi setelah beberapa saat ujung alat yang telah dialiri arus
listrik itu dicelupkan ke dalam air sungai? Ternyata ikan yang berada di
sekitar ujung alat itu terkena aliran listrik dan pingsan atau mati.
Apakah air dapat menghantarkan listrik?
Sebenarnya air murni adalah penghantar
listrik yang buruk. Akan tetapi bila dilarutkan asam, basa, atau garam
ke dalam air maka larutan ini dapat menghantarkan arus listrik. Zat-zat
yang larut dalam air dan dapat membentuk suatu larutan yang
menghantarkan arus listrik dinamakan larutan elektrolit. Contohnya
adalah larutan garam dapur dan larutan asam klorida. Zat yang tidak
menghantarkan arus listrik dinamakan larutan nonelektrolit. Contohnya
adalah larutan gula dan larutan urea.
Untuk mengetahui suatu larutan dapat
menghantarkan arus listrik atau tidak, dapat diuji dengan alat penguji
elektrolit. Alat penguji elektrolit sederhana terdiri dari dua elektroda
yang dihubungkan dengan sumber arus listrik searah dan dilengkapi
dengan lampu, serta bejana yang berisi larutan yang akan diuji. Mari
kita lakukan kegiatan berikut untuk mengetahui apakah asam, basa, dan
garam dapat menghantarkan arus listrik.
B. Identifikasi Asam, Basa, dan Garam
Banyak sekali larutan di sekitar kita,
baik yang bersifat asam, basa, maupun netral. Cara menentukan sifat asam
dan basa larutan secara tepat yaitu menggunakan indikator. Indikator
yang dapat digunakan adalah indikator asam basa. Indikator adalah
zat-zat yang menunjukkan indikasi berbeda dalam larutan asam, basa, dan
garam. Cara menentukan senyawa bersifat asam, basa, atau netral dapat
menggunakan kertas lakmus dan larutan indikator atau indikator alami.
Berikut adalah beberapa cara menguji sifat larutan.
1. Identifikasi dengan Kertas Lakmus
Warna kertas lakmus dalam larutan asam,
larutan basa dan larutan bersifat netral berbeda. Ada dua macam kertas
lakmus, yaitu lakmus merah dan lakmus biru. Sifat dari masing-masing
kertas lakmus tersebut adalah sebagai berikut.
a. Lakmus merah dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru.
b. Lakmus biru dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru.
c. Lakmus merah maupun biru dalam larutan netral tidak berubah warna.
b. Lakmus biru dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru.
c. Lakmus merah maupun biru dalam larutan netral tidak berubah warna.
2. Identifikasi Larutan Asam dan Basa Menggunakan Indikator Alami
Cara lain untuk mengidentifikasi sifat
asam atau basa suatu zat dapat menggunakan indikator alami. Berbagai
bunga yang berwarna atau tumbuhan, seperti daun, mahkota bunga, kunyit,
kulit manggis, dan kubis ungu dapat digunakan sebagai indikator asam
basa. Ekstrak atau sari dari bahan-bahan ini dapat menunjukkan warna
yang berbeda dalam larutan asam basa.
Sebagai contoh, ambillah kulit manggis,
tumbuklah sampai halus dan campur dengan sedikit air. Warna kulit
manggis adalah ungu (dalam keadaan netral). Jika ekstrak kulit manggis
dibagi dua dan masing-masing diteteskan larutan asam dan basa, maka
dalam larutan asam terjadi perubahan warna dari ungu menjadi
cokelat kemerahan. Larutan basa yang diteteskan akan mengubah warna dari
ungu menjadi biru kehitaman.
C. Penentuan Skala Keasaman dan Kebasaan
1. Kekuatan Asam dan Basa
Kekuatan suatu asam atau basa tergantung
bagaimana senyawa tersebut dapat diuraikan menjadi ion-ion dalam air.
Peristiwa terurainya suatu zat menjadi ion-ionnya dalam air disebut
ionisasi. Asam atau basa yang terionisasi secara sempurna dalam
larutan merupakan asam kuat atau basa kuat. Sebaliknya asam atau
basa yang hanya terionisasi sebagian merupakan asam lemah atau
basa lemah.
Jika ingin mengetahui kekuatan asam dan
basa maka dapat dilakukan percobaan sederhana. Perhatikan nyala lampu
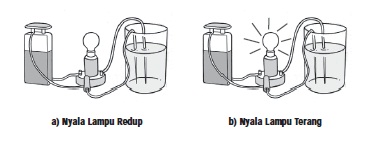
saat mengadakan percobaan uji larutan elektrolit. Bila nyala lampu
redup berarti larutan tergolong asam atau basa lemah, sebaliknya
apabila nyala lampu terang berarti larutan tersebut tergolong asam
atau basa kuat.
Asam kuat atau asam lemah pada
konsentrasi yang sama menghantarkan listrik yang berbeda. Nyala lampu
pada Gambar (a) tampak redup. Ini berarti larutan yang diuji berupa asam
lemah atau basa lemah. Adapun pada Gambar (b) lampu menyala terang,
menandakan bahwa larutan yang diuji berupa asam kuat atau basa kuat.
2. Derajat Keasaman dan Kebasaan (pH dan pOH)
Pada dasarnya derajat/tingkat keasaman
suatu larutan (pH = potenz Hydrogen)) bergantung pada konsentrasi ion H+
dalam larutan. Semakin besar konsentrasi ion H+ semakin asam larutan
tersebut.
Umumnya konsentrasi ion H+ pada larutan
sangat kecil, maka untuk menyederhanakan penulisan digunakan konsep pH
untuk menyatakan konsentrasi ion H+. Nilai pH sama dengan
negatif logaritma konsentrasi ion H+ dan secara matematika
dinyatakan dengan persamaan
pH = – log (H+)
Analog dengan pH, konsentrasi ion OH–
juga dapat dinyatakan dengan cara yang sama, yaitu pOH (Potenz
Hydroxide) dinyatakan dengan persamaan berikut.
pOH = – log (OH-)
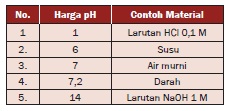
Derajat keasaman suatu zat (pH) ditunjukkan dengan skala 0—14.
a. Larutan dengan pH < 7 bersifat asam.
b. Larutan dengan pH = 7 bersifat netral.
c. Larutan dengan pH > 7 bersifat basa.
Jumlah harga pH dan pOH = 14. Misalnya,
suatu larutan memiliki pOH = 5, maka harga pH = 14 – 5 = 9. Harga pH
untuk beberapa jenis zat yang dapat kita temukan di lingkungan
sehari-hari dinyatakan dalam Tabel.
Tabel Harga pH untuk Beberapa Jenis Zat
3. Menentukan pH Suatu Larutan
Derajat keasaman (pH) suatu larutan dapat
ditentukan menggunakan indikator universal, indikator stick, larutan
indiaktor, dan pH meter.
a. Indikator Universal.
Indikator universal merupakan campuran
dari bermacam-macam indikator yang dapat menunjukkan pH suatu
larutan dari perubahan warnanya. Indikator universal ada dua macam yaitu
indikator yang berupa kertas dan larutan.
b. Indikator Kertas (Indikator Stick)
Indikator kertas berupa kertas serap dan
tiap kotak kemasan indikator jenis ini dilengkapi dengan peta warna.
Penggunaannya sangat sederhana, sehelai indikator dicelupkan ke
dalam larutan yang akan diukur pH-nya. Kemudian dibandingkan dengan peta
warna yang tersedia.
c. Larutan Indikator
Salah satu contoh indikator universal
jenis larutan adalah larutan metil jingga (Metil Orange = MO). Pada pH
kurang dari 6 larutan ini berwarna jingga, sedangkan pada pH lebih dari 7
warnanya menjadi kuning.
Contoh indikator cair lainnya adalah
indikator fenolftalin (Phenolphtalein = pp). pH di bawah 8, fenolftalin
tidak berwarna, dan akan berwarna merah anggur apabila pH larutan di
atas 10.
d. pH Meter
Pengujian sifat larutan asam basa dapat
juga menggunakan pH meter. Penggunaan alat ini dengan cara dicelupkan
pada larutan yang akan diuji, pada pH meter akan muncul angka skala
yang menunjukkan pH larutan.
Minggu, 03 Maret 2013
About Me
Nama saya Husnul Nawafil. Saya sekarang bersekolah di Fatih Bilingual School. Agama saya Islam.
Jika ada keluhan anda dapat menghubungi saya di Facebook dengan nama Husnul Nawafil (husnulnawafil@ymail.com), Twitter dengan mem-follow @HusnulN (h.nawafil@yahoo.co.uk). Thanks atas kunjungannya.
The Revised Chemiosmotic Theory (2013)
On this article, i will explain about problem in revision of Electron Transport System in mitochondria.
The big question is : "how many ATP produced in aerobic respiration?
if you read, some source say 36/38 but the other 30/32. which one is
true?"
One day, I got a case from my tutorial class, this case talks about Obesity and Hypercholesterol in a patient. This is the study method in my faculty (medical faculty), we got one case every week. In med faculty nowadays, we study from the case first and slowly begin to reach the basic science, which is related to the case. We were forced to understand the basic science, so we can solve the problem. This is important because, phylosophically, in doctor's daily life they always presented with cases from the patient.
So, lets begin..
Respiration is one of the process in organism to gain energy. So special because this kind of process gain the biggest energy rather than the other.
Divided into four step : Glycolisis, Oxidative Decarboxialtion, Kreb cycle/TCA cycle, and Electron Transport System (ETS)
(also, some said only three step, they grouped DO into TCA cycle, whatever it is, the reaction still the same)
from Campbell Biology
but, look at this too :
from Lehninger Biochemistry
The question is :
*Which one is true? 36/38 atp or 30/32 atp?
This difference make me confused, until i try to figure out what is going on and then realize that "book released in 2006 and later" did some kind of revision saying "ATP produced in one complex oxidation process result 30/32 atp" (not 36/38 atp).
*But, how could this revision was made?
The key to understand this is to know in detail about Electron Transport System process, how complex 1,2,3 and 4 work together. This main distinction actually come from the change in understanding of how NADH / FADH release H+ and produce ATP.
new revised chemiosmotic theory :

old theory :

so, now we use the new theory that said:
NADH gain 10 H+
FADH gain 6 H+
*But, why one Hidrogen ion result in 2.5 atp, why not integer value like 1 ATP?
Old theory said 1 H will pass ATP synthase result in 1 ATP, but now research said the system not like that.
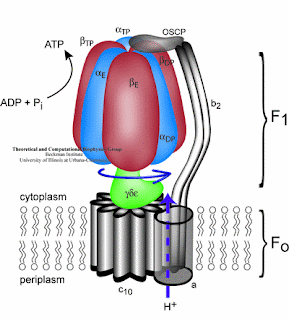
Take a look inside the new theory of ATP Synthase:
New properties of ATP synthase :
- ATP synthase is comprised of F1 and F0 molecule. F1 is alpha and beta component, F0 is C component. where H+ will be inserted in C component, so the C component can rotate.
- There are 12 slots for hidrogen ion in C component to be inserted. Hidrogen has to fulfill the slot so it can rotate.
- When C component rotates 360 degrees, the ATP synthase resulting 2.5 ATP.
Then, the conclusion is:
1 rotation = 3 ATP
1 rotation = need 12 hydrogen ion
12 H = 3 ATP -> 4 H = 1 ATP
NADH = resulting 10 H
(10 H / 4 H) * 1 ATP = 2.5 ATP
FADH = resulting 6 H
(6 H / 4 H) * 1 ATP = 1.5 ATP
reference :
Whitney Ellie, 2008, Understanding Nutrition 11th edition
Murray Robert K., 2009, Harper's Illustrated Biochemistry 28th edition
Langganan:
Postingan (Atom)